
程
讯
合
补充手性药物的基本知识:药物分子的手性和手性药物
凡是连有4个不同的原子或基团的碳原子称为
手性碳原子,具手性原子的称手性药物
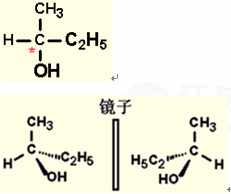
当药物分子结构中引入手性中心后,得到一对互为实物与镜象的对映异构体(R构型、S构型)
四个基本概念:
1.构型:R、S(氨基酸、糖等习惯用D、L);

按原子叙述排列的序列将直接与不对称碳原子连接的四个原子或原子团依次从低到高,用1至4标出来,最低原子序数的原子团为1,其次为2,依次类推。
将表明1的原子或原子团放在距观察者最远的位置,沿着4、3、2的顺序画圈,若是顺时针,称作R型,若为反时针方向,则为S型
Cl,S,F,O,N,C,H第一个原子相同时比第二个
构型D/L

其它凡是可由D-(+)-甘油醛通过化学反应衍生得到的化合物,或者是通过化学反应可变成D-(+)-甘油醛的化合物,只要变化过程中不涉及到不对称碳原子的构型,它们与D-(+)-甘油醛具有相同的构型,都是属于D型的。反之,与L-(-)-甘油醛具有相同构型的化合物,就是属于L型的。
2.旋光性:(+)右旋、(—)左旋、(±)消旋;
手性药物都具有旋光性:偏振光的振动面习惯称为偏振面。用旋光仪测定,当平面偏振光通过手性药物溶液后,偏振面的方向就被旋转了一个角度(左旋或右旋),称为旋光性。
3.一对对映体等量的混合物称外消旋体;
4.分子中有对称面的称内消旋体;
对考试的要求:有手性中心的药物,具有对映异构体,不同异构体的活性、代谢和毒性都有一定差异。
第二篇 化学治疗药物
第四章 抗生素
抗生素结构类型:β-内酰胺类、四环素类、氨基糖苷类、大环内酯类、氯霉素类、其他结构类型。
作用机制:
抑制细菌细胞壁的合成:β-内酰胺类抗生素
与细胞膜相互作用:多粘菌素和短杆菌素
干扰蛋白质的合成:大环内酯、氨基糖苷类、四环素类和氯霉素等
抑制核酸的转录和复制:利福霉素
第一节 β-内酰胺类抗生素
β-内酰胺类抗生素的分类:青霉素类、头孢菌素类、β-内酰胺酶抑制剂类、非经典β-内酰胺抗生素类。
β-内酰胺类抗生素的构效关系
青霉素类 头孢菌素类
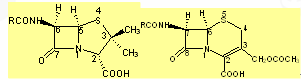
1. 两类化合物分子中均含有β-内酰胺的四元环。青霉素为β-内酰胺环与四氢噻唑环并合,而头孢菌素则为β-内酰胺环和氢化噻嗪环并合。

2. 两类药物分子中均含有羧基,其酸性足以与碱金属离子形成有机盐,使稳定性提高。

3. 两类药物分子中均含有伯氨基,可与各种酰基结合形成半合成β-内酰胺类抗生素,青霉素族抗生素在6位,而头孢菌素族抗生素在7位,分别被称为6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)。[NextPage]
4. 6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)本身可以被看作与两个氨基酸所形成的肽。
5. 两类药物分子中均含有多个不对称碳原子,如青霉素的2、5、6位和头孢菌素的6、7位,因而均具有旋光性。
6.头孢菌素类抗生素的3位侧链的次甲基处于丙烯位,其氢可被其他基团取代,而此部位的改变可以增加抗均活性和改变其药物代谢的动力学性质。

7. 6-APA和7-ACA是β-内酰胺类抗生素保持其生物活性的基本结构,而侧链酰基引入则可调节其抗菌谱和对酶的作用方式、抗菌作用的强度及理化性质。
β-内酰胺类抗生素的作用是抑制粘肽转肽酶,阻碍细菌细胞壁的形成。细胞壁是细菌细胞所特有的,而哺乳动物细胞无细胞壁,因而β-内酰胺类抗生素对哺乳动物无影响,其作用具有较高的选择性。此外,革兰阳性菌的细胞壁粘肽含量比革兰阴性菌高,因此青霉素一般对革兰阳性菌的活性比较高,也造成其抗菌谱比较窄的问题。
一、 青霉素及半合成青霉素类
代表性药物:青霉素钠、氨苄西林、阿莫西林、哌拉西林、替莫西林
共同结构特点:以青霉烷酸为母体,在6位连有不同的取代基,三个手性碳构型为2S,5R,6R。
青霉素钠 BenzylpeniCillin Sodium

结构特点:6位连有苯乙酰氨基
化学名为 (2S,5R,6R)-3,3- 二甲基 -6-(2-苯乙酰氨基)一 7- 氧代 -4 一 硫杂 -1 一氮杂双环 [3,2,0]庚烷-2- 甲酸钠盐。也称青霉素G 钠。
以4 一 硫杂 -1 一氮杂双环 [3,2,0]庚烷为母体,在3位连有二甲基,6位连有2-苯乙酰氨基,7位氧代,2位连有甲酸钠。提示:此庚烷由双环组成,除共用边的两个原子外,五元环还有三个原子,四元环还有两个原子,故称为双环[3,2,0]庚烷。

理化性质:有机酸,不溶于水,临床使用钠盐或钾盐。水溶液在室温下不稳定,易分解。临床使用粉针剂。有3个手性碳原子,其立体构型为2S,5R,6R。
青霉素G,也称苄基青霉素,是第一个用于临床的抗生素,在发酵时加入少量苯乙酸或苯乙酰胺可提高产量。
不稳定原因:环张力大;β-内酰胺环中羰基与氮原子上的孤对电子不能形成共轭
不同条件下的分解产物:
在强酸加热或氯化汞存在条件下,发生裂解,生成青霉酸和青霉醛酸。青霉酸不稳定,释放青霉醛和青霉胺;在稀酸溶液(PH4.0),室温生成青霉二酸;在碱性或β-内酰胺酶存在下,生成青霉酸。
青霉素 G 在临床上只能注射给药。为了延长青霉素在体内的作用时间,可将青霉素和丙磺舒合用, 以降低青霉素的排泄速度 ; 也可将青霉素和分子量较大的胺制成难溶性盐,维持血中有效浓度有较长的时间,如普鲁卡因青霉素和苄星青霉素 ; 也可将青霉素的羧基酯化,使在体内缓慢释放青霉素。
用途:
过敏原因:青霉噻唑高聚物。
青霉素类抗生素之间能发生强烈的交叉过敏反应。
青霉素的主要缺点:
不能口服、抗菌谱窄、对β-内酰胺酶不够稳定、半衰期短以及极少数人可发生严重过敏反应
1.耐酸半合成青霉素:侧链具有吸电子基团
2.耐酶半合成青霉素:侧链酰胺上引入体积较大的基团
3.广谱半合成青霉素:将一些极性基团引入到酰胺侧链中
氨苄西林 Ampinillin

结构特点:6位连有2-氨基-苯乙酰氨基
化学名:6-[D-(-)2-氨基-苯乙酰氨基]青霉烷酸的三水化合物。
以青霉烷酸为母体,在6位连有D-构型的2-氨基-苯乙酰氨基
性质:半合成青霉素
有引湿性;水中微溶;两性;苄位为手性碳,结构中有四个手性中心。
水溶液不太稳定,除发生分解反应,还有聚合。
鉴别反应:本品具有α-氨基酸性质,与茚三酮试液作用显紫色,加热后显红色;有肽键结构,可发生双缩脲反应开环,使碱性酒石酸铜还原显紫色
氨苄西林钠为第一个用于临床的广谱半合成青霉素。有耐酸作用,临床用粉针剂,主要用于肠球菌,痢疾杆菌,伤寒杆菌,大肠杆菌和流感杆菌等引起的感染。[NextPage]
阿莫西林

结构特点:6位连有2-氨基-(4-羟基-苯乙酰氨基)
结构中有酸性的羧基,弱酸性的酚羟基,碱性的氨基。侧链引入手性碳,R构型,右旋体。也会发生青霉素的降解反应和氨苄西林的聚合反应。
同氨苄西林,会发生分子内成环反应,生成2,5吡嗪二酮

临床主要用于敏感菌所致泌尿系统、呼吸系统、胆道等的感染,口服吸收较好。
| 广告合作:400-664-0084 全国热线:400-664-0084 Copyright 2010 - 2017 www.my8848.com 珠峰网 粤ICP备15066211号 珠峰网 版权所有 All Rights Reserved 
|